Ventilatie en oxygenatie
I. Welke "onderdelen" in ons lichaam zorgen voor oxygenatie van de weefsels?
A. Hartpomp
B. Longweefsel: alveoli
C. Bloedsomloop
D. Perifeer vaatbed
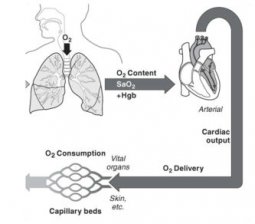
Fig. 1: De onderdelen die nodig zijn voor een goede oxygenatie van de weefsels zijn: De longen, het hart, de bloedsomloop, het perifeer vaatbed
II. Moeder waarom ademen wij?
A. Weefsel van zuurstof voorzien (oxygenatie)
B. CO2 uit te ademen (ventilatie)
III. Oxygenatie
A. De zuurstofbalans
Wat zijn de onderdelen van de zuurstofbalans?
Zuurstoftoevoer
Zuurstofconsumptie

Fig. 2a: De normale zuurstofbalans van weefsels:
Het zuurstofevenwicht thv de weefsels wordt bepaald door de verhouding van de zuurstoftoevoer en de zuurstofbehoefte , zoals aangegeven in figuur 2a. Verhoging van de zuurstoftoevoer in de weefsels kan door hetzij verhogen van het zuurstofgehalte in arterieel bloed, ofwel door toename van de bloedstroom (door verhoging van de cardiac output).
Toename van het zuurstofverbruik zonder toename van de zuurstoftoevoer verlaagt de weefsel zuurstof niveaus. In normale omstandigheden zal bij een toename van de zuurstofbehoefte een evenredige toename van de zuurstoftoevoer ontstaan. Hierdoor blijven de weefsel zuurstof niveaus gehandhaafd in tijden van verhoogde zuurstofbehoefte. De zuurstofbalans is in evenwicht.
Deze toename van de bloedtoevoer en arteriële zuurstofniveaus wordt uitgevoerd door regulerende mechanismen .
Hoe ontstaat onevenwicht in de zuurstofbalans?
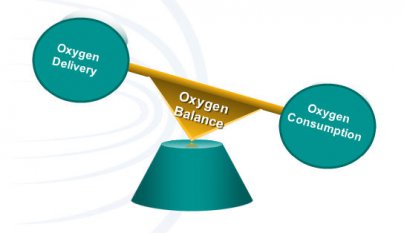
Fig. 2b: De verstoorde zuurstofbalans van weefsels
Figuur 2b toont een verstoorde zuurstofbalans, waarbij het zuurstofaanbod niet voldoet aan de zuurstofconsumptie. Deze verstoorde koppeling tussen zuurstofverbruik en toevoer kan bijvoorbeeld ontstaan bij hartziekte waarbij de cardiac output daalt. Alle andere oorzaken waardoor de opname thv de longen, de transportcapaciteit van het bloed of de afgifte van zuurstof ter hoogte van de weefsels vermindert, verstoren eveneens de zuurstofbalans. Wanneer de zuurstoftoevoer vermindert ten opzichte van de vraag, of wanneer niet aan een verhoogde vraag wordt voldaan door verhoogde toevoer, treedt dan zuurstoftekort ter hoogte van de weefsels of weefselhypoxie op. Hypoxemie betekent een verlaagd zuurstofgehalte in het bloed, terwijl hypoxie betekent dat de weefsels die zuurstof nodig hebben dit onvoldoende krijgen. Hierbij treedt dan anaerobe glycolyse op. Hierbij worden de suikers thv de weefsels niet verbrand, maar opgesplitst, waarbij melkzuur vrijkomt. Dit melkzuur valt uiteen in een negatief geladen lactaat-ion en een positief geladen waterstof ion (H+). De ophoping van H+ veroorzaakt verzuring of acidose. Het lactaat kunnen we meten in het bloed (meestal via een arteriële bloedname) en geeft een idee van de graad van anaerobe glycolyse.
B. Wat zijn de determinanten van zuurstoftoevoer naar de weefsels?
Bloedflow (cardiac output)
Deze is afhankelijk van
Hartritme
Slagvolume: deze is afhankelijk van
Preload: deze is afhankelijk van
Veneuse return
Ventriculaire compliance
Preload beïnvloedt ook de contractiliteit
Afterload
Arteriele bloeddruk
Contractiliteit

Fig. 3: De determinanten die bepalend zijn voor de oxygenatie van de weefsels.
De arteriële zuurstofconcentratie geeft ons een idee over de hoeveelheid zuurstof dat via de longen in ons bloed terecht komt. De bloedflow wordt bepaald door de cardiac output of het volume bloed dat het hart per minuut rond pompt. Hierbij zijn het slagvolume en de hartfrequentie bepalend. Uiteraard is de vullingstoestand hierbij van belang. De zuurstofconsumptie kan worden geschat door de verhouding van arterieel en gemengd veneus bloed te meten.
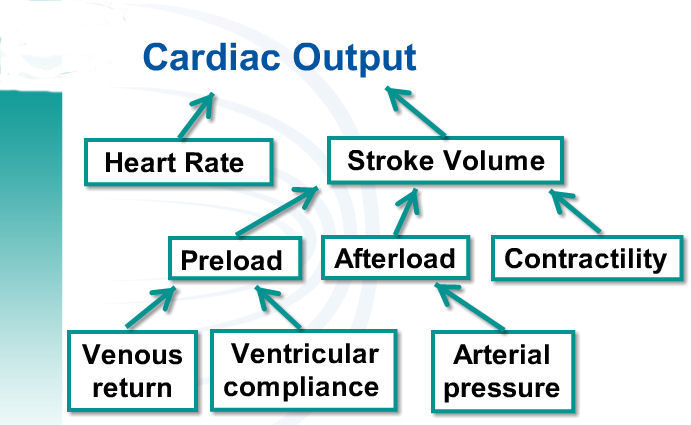
Fig. 4: De cardiac output wordt bepaald door de hartfrequentie x het slagvolume. Het slagvolume is afhankelijk van de preload, de afterload en de contractiliteit van het hart.
De preload wordt enerzijds bepaald door de hoeveelheid bloed dat via de venae cavae wordt aangeboden (veneuze return) en anderzijds door de compliance (elasticiteit) van de rechter ventrikel. Deze laatste kan verminderd zijn door myocardhypertrofie door langdurig hartfalen.
De afterload wordt vooral bepaald door de perifere weerstand waartegen het linkerhart moet pompen. De wordt gemeten in de arteriële bloeddruk (vooral de diastolische bloeddruk of de onderdruk).
Zuurstofconcentratie in arterieel bloed
Hemoglobine
Zuurstofsaturatie van oxyhemoglobine
Arterieel: 95-100%
1.34 ml O2/g hemoglobine
Veneus: 75%

Fig. 5 De werking van hemoglobine. Ter hoogte van de alveolaire circulatie neemt hemoglobine zuurstof op. Hierbij zal het hemoglobine satureren tot 95-100%. Het wordt via de arteriële circulatie naar de perifere weefsels gepompt. Daar staat de zuurstof af. Hierbij daalt de saturatie van hemoglobine tot 75%. Dat wordt via de veneuze circulatie terug naar het rechter hart gepompt en van hieruit terug naar de longen.
De zuurstofsaturatiecurve van de zuurstofreserve
Tussen 100 en 75%: zuurstofopname tijdens normaal metabolisme
75-20%: zuurstofreserves die van het hemoglobine kunnen worden afgehaald bij toegenomen vraag
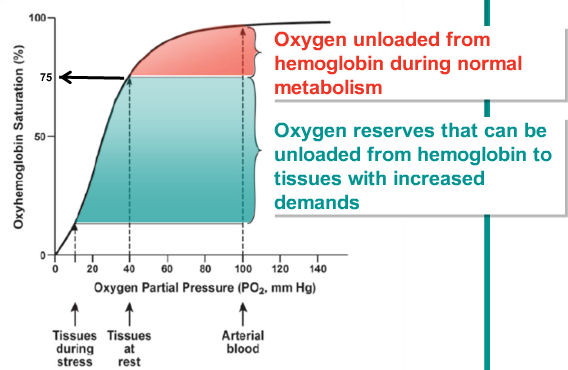
Fig. 6: De zuurstofsaturatiecurve: De hemoglobine zal in de longen worden opgeladen met zuurstof tot een saturatie van 95-100%. Hierdoor ontstaat een partiële zuurstofdruk tot 100 mmHg. In de perifere weefsels staat hemoglobine de zuurstof af, waardoor de partiële zuurstofdruk daalt tot 40 mmHg. De hemoglobine blijft dan ongeveer 75% gesatureerd. De verhouding van de zuurstofsaturatie tot de partiële zuurstofdruk is echter niet lineair. Daling van de saturatie in arterieel bloed lager dan 90% leidt tot een ernstige daling van het reële zuurstofgehalte of de partiële zuurstofdruk. Daarom moet men de zuurstofsaturatie bij een patiënt steeds boven 90-92% houden. Bij lagere saturatie zal de patiënt ernstige hypoxemie krijgen door ernstig verlagen van de partiële zuurstofdruk in het bloed. Indien de zuurstofnood thv de weefsels door inspanning of koorts plots ernstig toeneemt, kan de hemoglobine nog meer zuurstof afgeven, tot een minimale saturatie van 20%. Deze zuurstofreserve vormt onze redding bij acute inspanning, een reanimatie of bij hoge koorts en voorkomt dat de weefsels dan onmiddellijk afsterven. Nochtans is deze werking niet optimaal. Als veneus bloed zich minder dan 75% gesatureerd aanbied aan de longen, zal het niet snel genoeg terug maximaal kunnen satureren tot tegen 100%.
IV. Ventilatie
A. De PaCO 2 is de partiële koolstofdioxidedruk in arterieel bloed.
B. De PaCO2 komt overeen met de resterende hoeveelheid kooldioxide in het arteriële bloed na verwijdering van koolzuur in de longen.
C. We bespreken ventilatie verder in
de vrije luchtweg en masker-ballonbeademing
beademingsvormen
V. De pathofysiologische vormen van respiratoir falen
A. Hypoxemie: Falen van de oxygenatie
Bij kamerlucht is de verwachte PaO2: </= 50-60 mmHg
Aandoeningen die hypoxemie veroorzaken
Pneumonie: Op Rx thorax: frequent infiltraten
Hartfalen met longoedeem
ARDS
Bronchospasmen: COPD, Astma
Trauma: longcontusie, longlaceratie
Andere aandoeningen
Interstitieel longlijden
Longembolie
Longatelectase
Mucoviscidose
Neoplasieën
Pathofysiologische indeling van de oorzaken van hypoxemie
Mismatch in ventilatie/perfise (V/Q)
Shunt effect (links-rechts shunt) : Wel perfusie, geen ventilatie
Ventilatie naar de alveoli is geblokkeerd
Aandoeningen
ARDS
Atelectase
Pneumonie
Longoedeem
Behandeling bij shunt
Zuurstof: Helpt niet in die longdelen waar geen ventilatie is
Opheffen of verkleinen van het shuntgebied
Atelectase opheffen
Longoedeem: diuretica om het water uit te scheiden
Cardiale medicatie
Dode ruimte effect: wel ventilatie; geen perfusie
Er is wel voldoende zuurstof in de alveoli maar problemen in het capillair bed zodat er geen uitwisseling plaats kan vinden
Aandoeningen of oorzaken
Longembolie
Hoge beademingsdrukken
Alveolaire hypoventilatie
Alcohol
Sedativa
Hersenletsel
Neuromusculaire ziekte
Hypercapnie
Verminderde diffusie thv de alveoli (zeldzamer)
Interstitieel oedeem
Inflammatie
Longfibrose
Amyloidose
Hoogte
Therapie bij hypoxemie
Aanpassen van de toegediende zuurstofconcentratie
Toedienen van CPA P: Continuous Positieve Airway Pressure
Bij beademde patiënten: verhogen van de PEEP (Positive end expiratoiy pressure)
B. Hypercapnie: Falen van de ventilatie
PaCO2 >/= 50mmHg met pH<7.36
Pathofysiologische indeling
Verhoogde CO2 productie door verhoogd metabolisme
Brandwonden
Hyperthyroïdie
Hardnekkige koorts
Verminderde effectieve alveolaire ventilatie
Centrale ademdepressie
Traumatisch hersenletsel
Sedatieve medicatie
Metabole stoornissen
Falen van de "respiratoire pomp"
Verminderde kracht van de ademhalingsspieren
Neuromusculaire ziekte
Uitputting
Verhoogde mechanische belasting
Verhoogde luchtwegweerstand door bronchoconstrictie
Asthma
COPD
ARDS
Obesitas
Auto-PEEP / hyperinflatie
Toename van de dode ruimte
Longembolie
Gedaalde cardiac output
Hypovolemische shock
Hoge druk in de luchtwegen
Oorzaken die hypercapnie veroorzaken ingedeeld per anatomische groep
Centraal zenuwstelsel
Intoxicaties
Opioiden
Benzodiazepines
Barbituraten
Anesthetica
Vergif
Metabole oorzaken
Hyponatriëmie
Hypocalcemie
Alkalose
Myxoedeem
Neoplasma
Infecties
Meningitis
Encefalitis
Polio
Hersenabces
West Nijl myelitis
Verhoogde intracraniële druk
Andere
Centrale alveolaire hypoventilatie
Slaapapnee
Perifere zenuwen en spieren
Trauma
Ruggemergletsel
Diafragmaletsel
Intoxicatie
Neuromusculaire blokkade
Aminoglycosiden (antibiotica)
Arsenicum
Strychnine
Botulisme
Metabool
Hypokaliemie
Hyperkaliemie
Hypofosfatemie
Hypomagnesemie
Neoplasma
Infecties (o.a. tetanus)
Bovenste luchtweg
Weefselopzetting
Keelontsteking
Hyperplasie
Keeltumoren
Poliepen
Goiter
Infectie
Epiglottitis
Laryngotracheitis
Trauma
Thorax
Trauma
Ribfracturen
Fladderthorax
Escharen van brandwonden
Andere factoren die bijdragen
Pneumothorax
Pleuravochtuitstorting
Liggende positie
Obesitas
Pijn
Ascites
Misvormingen van de thorax
Kyfoskoliose
Spondylitis
Verstijving van de thorax
Op Rx thorax eerder beeld van hyperinflatie
Behandeling kan enkel door de oorzaak te behandelen
Vochttherapie
Verbeteren van de cardiac output
Verminderen van de beademingsdruk
Oplossen van de vaatobstructie (embolen)
C. Mixed: voorbeelden
COPD
Ernstig congestief hartfalen
Multifactorieel bij kritische patient

Fig 7. Pink puffer versus blue bloater:
De vergelijking van deze twee patiëntengroepen toont duidelijk de essentie van het verschil tussen ventilatie en oxygenatie. Sommige aandoeningen verstoren vooral de oxygenatie (oa pneumonie en chronische bronchitis). Hierbij zal de mucusproductie de diffusie van zuurstof verstoren thv de alveoli. Het capillair vaatbed is echter niet beschadigd en de ventilatie voor de CO2 uitademing niet of minder verstoort. De patiënt is vooral hypoxemisch en zal er cyanotisch uit zien, zich erg moe voelen en eerder opgezet zijn (bloating= zwelling).
Bij de pink puffer zal door longemfyseem de alveoli en het capillair vaatbed thv de alveoli beschadigen. De oxygenatie zal ook dalen. De patiënt zal dit compenseren door te hyperventileren (puffer). Hierdoor stijgt de oxygenatie en zal de patiënt er minder cyanotisch uit zien (pink). Vanwege de gedaalde cardiac output zullen deze personen ernstig vermageren en er cachectisch uit zien.

Voeg een nieuwe reactie toe
Login om te reageren